
ESTRUCTURA INTERNA DE LOS ÁTOMOS
Cuando hablamos de algo que sucede periódicamete, hablamos de eventos que se llevan acabo repetidamente como cuando todos los domingos jugamos en el parque, o cuando mensualmente nos hacen el cobro de los recibos públicos, esto es algo periódico es decir que se repite.
Te ha sucedido que te pasa corriente cuando tocas a alguien que está en movimiento, o en la noche las cobijas se electrizan y chisporrotean o cuando te quitas un saco de lana pasa algo similar? Toda la materia que existe en el universo está formada por átomos, átomos de calcio, de helio, de magnesio y de todos los elementos químicos que se conocen. El sol está formado por hidrógeno, y nosotros estamos formados por muchos elementos químicos.
Por ejemplo cuando comemos sal, ésta se transforma en nuestro organismos en cargas positivas y cargas negativas para que puedan entrar en la célula y desempeñar sus funciones.
Para que esto suceda y se formen cargas eléctricas, uno de los átomos debe ceder electrones que tienen carga negativa y el otro ganarlos. Por ello en química debemos analizar unas propiedades que intervienen en este proceso.
Las propiedades periódicas de los elementos químicos son características de los elementos que varían de manera regular de acuerdo con la posición que ocupan en la tabla periódica. Esta organización permite predecir las características físicas y el comportamiento químico de su determinado elemento.
Para ello empezaremos recordando la distribución de los electrones en el átomo,la importancia de los orbitales atómicos para realizar la estructura de Lewis y la formación de aniones y cationes.


El diagrama anterior nos indica la forma como se distribuyen los electrones en los niveles de energía, se debe seguir la dirección de la flecha y el orden de lectura, cuando hay dos o más valores en una misma flecha, se lee y escribe de arriba hacia abajo. (Azul-morado), (verde-azul-morado).
Ejemplo:
Mg
Número atómico 12
2 2 6 2
1S 2S 2P 3S
Período: 3 , total 3 períodos, NO se cuenta por separado el que se repite.
Grupo: 2 , electrones que se encuentran en el último nivel de energía en este caso se encuentran en el nivel 3
Niveles de Energía: 3
Br Z= 35 (número atómico 35, 35 protones en el núcleo, son cargas positivas).
Entonces con la configuración electrónica debemos llegar hasta completar 35 electrones para que el átomo sea neutro.
2 2 6 2 6 2 10 5
1S 2S 2P 3S 3P 4S 3d 4P
Este es el orden según el diagrama de Moeller.
Los números grandes corresponden a los niveles de energía, (Coeficientes), las letras corresponden a los subnivles de energía y los números pequeños (superíndices)son los electrones que están en cada subnivel.
Al final se colocó el número 5 en 4P5, porque hasta ahí completamos los 35 electrones, se disminuye este último valor hasta completar los electrones que necesitamos.
Según este ejemplo hay:
4 niveles de energía.
Primer nivel 1= tiene 2 electrones
segundo nivel 2 = tiene 8 electrones porque se repite el nivel. (se sumaron los superíndices.)
Tercer nivel 3 = tiene 18 electrones ( se suman los electrones de todos el nivel 3.)
Cuarto nivel 4 = tiene 7 electrones que llamamos electrones de valencia.
El coeficiente más grande osea el 4 corresponde al período en que se encuentra, es decir la posición horizontal en la tabla periódica. y los electrones que estén en ese período corresponden al grupo en este caso VIIA.
Período=4
Grupo 7
Verifiquen en la tabla periódica.
ESTE GRÁFICO CORRESPONDE AL ELEMENTO SODIO Y LOS ELECTRONES QUE TIENE EN CADA NIVEL DE ENERGÍA.
Elabora la configuración electrónica para este elemento. Coindice con la distribución de los electrones con el gráfico anterior?
ORBITALES ATÓMICOS
Son una región del espacio del átomo donde se encuentran los electrones. Los orbitales del subnivel S son circulares alrededor del núcleo. Puede haber hasta siete orbitales S, porque hay siete niveles de energía, observa los orbitales 1S, 2S Y 3S en el siguiente gráfico.
Los orbitales que se encuentran en el subnivel P, no son circulares sino que tienen lóbulos como en el siguiente ejemplo y están en los ejes de un plano cartesiano X, Y , Z




La configuración electrónica entonces contiene para cada átomo:
-
Niveles de Energía
-
Subniveles de energía
-
Orbitales atómicos.
La configuración por orbitales atómicos nos es de gran ayuda para elaborar la estructura de lewis, es decir la distribución de los electrones alrededor del símbolo con la fórmula electrón punto.
Por ejemplo:
2 2 6 2
1 S 2S 2P 3S
Estructura de Lewis

Video explicativo

TALLER 1:
Realiza la configuración electrónica para los siguientes elementos químicos: de los grupos IA, IIA, VIIA
, e indica en cada uno de ellos:
-
Configuración por orbitales atómicos. (Flechas= Spin electromagnético)
-
Dibujo del átomo con las orbitas y electrones en cada una de las órbitas.
-
Grupo= Electrones del último nivel de energía. (si se repite se deben sumar).
-
Período= Mayor coeficiente en la configuración electrónica, o mayor nivel de energía.
-
Número de Niveles de Energía.
Gracias.
LEY DEL OCTETO Y ESTRUCTURA DE LEWIS
Con el objetivo de dar continuidad al tema, una vez comprendido el concepto de spin electromagnético y orbital atómico, pasaremos a enunciar la ley del octeto y la estructura de Lewis.
La Ley del octeto tiene como finalidad dar estabilidad tanto a átomos de elementos químicos, como a átomos dentro de compuestos químicos.
La ley del octeto se enuncia como la capacidad que tiene un átomo para completar 8 electrones de valencia en su último nivel de energía, tal como lo tienen los gases nobles. Para completar este octeto los átomos atraen electrones de otros átomos hasta el punto de capturarlos. Por ejemplo los elementos halógenos situados en el grupo VIIA presentan siete electrones de valencia, sólo les falta un electrón para completar su octeto, el cual pueden tomar fácilmente cuando se ponen en contacto con elementos del grupo IA, que poseen un electrón de valencia.
Cuando esto sucede se forman iones, es decir partículas cargadas eléctricamente, positivas y negativas.
El átomo que GANA electrones porque tiene más energía para atraer electrones queda cargado negativamente y se convierte en un ANIÓN (-).
El átomo que PIERDE electrones porque posee menos energía para atraer sus electrones de valencia, queda cargado positivamente y se convierte en un CATIÓN (+).


En la primera imagen está el átomo neutro con tres protones en el núcleo y tres electrones en la periferia en los niveles de energía, cuando este átomo pierde su neutralidad porque gana o pierde elctrones se convierte en un IÓN.
En la segunda imagen se evidencia la formación de un catión (positivo), cuando pierde electrones y de un anión (negativo), cuando gana electrones.
Utilizando los electrones de valencia ubicados en el último nivel de energía, y de acuerdo con la regla de Hund de la disposición de los electrones en los orbitales, realizaremos la estructura de Lewis, que consiste en colocar el símbolo del elemento con la distribución de los electrones de valencia de acuerdo con el spin electromagnético. así:
2 2 6 2 6 2 10 4
1S 2S 2P 3S 3P 4S 3D 4P
El selenio tiene seis electrones de valencia. dos en parejas del subnivel 4S , dos en parejas del subnivel 4p, y dos electrones desapareados en el orbital Py y Pz.


Video Explicativo
PROPIEDADES PERIÓDICAS

Las propiedades periódicas de los elementos químicos tienen influencia en la disponibilidad de nutrientes en suelos ya que el tamaño atómico o el potencial de ionización puede hacer que los nutrientes estén de manera disponible para que las plantas los absorban a través de las raíces, si hay competencia entre algunos elementos químicos en la solución del suelo, el elemento con mayor tamaño atómico o mayor potencial de ionización puede llegar a bloquear otro con menores rangos, ya que los electrones están mas alejados del núcleo y pueden formar iones más fácilmente logrando así un proceso de nutrición adecuado.
ELECTRONEGATIVIDAD
La electronegatividad es una medida que muestra la energía con que un átomo atrae los electrones que participan en un enlace químico. Cuando un átomo tiene más electrones de valencia atrae electrones de otros átomos para ser más estable.
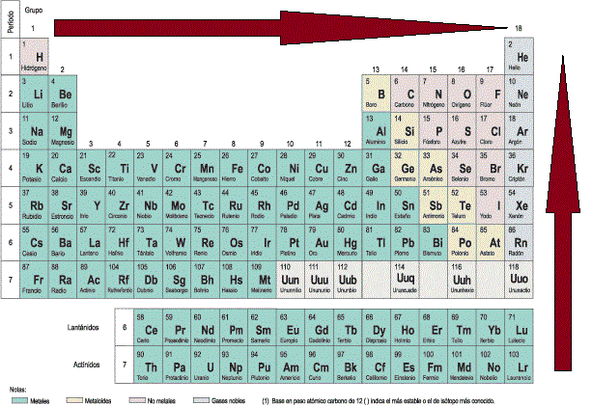
En la tabla periódica la electronegatividad aumenta de izquierda a derecha a lo largo de los periodos debido a que se incrementa el número de protones en el núcleo aumentando también la atracción que ejerce el núcleo sobre los electrones de valencia.
En los grupos la electronegatividad aumenta de abajo hacia arriba, por que disminuyen los niveles de energía lo cual ocasiona mayor atracción de los electrones de valencia con su núcleo.
Ejemplo:
a. Mg - Sr
R/ El Mg tiene menos niveles de energía (está más arriba), por lo que es más electronegativo que el Sr en el grupo II de la tabla periódica.
b. Ca - Ni
R/ El Ni es más electronegativo que el Ca porque se encuentra más hacia la derecha. El Ni tiene más protones lo que hace que atraiga más los electrones de valencia.
La siguiente gráfica explica el comportamiento de la electronegatividad.
RADIO ATÓMICO
Es la distancia que hay desde el núcleo al electrón más externo. Se mide en Angtroms. En un grupo de la tabla periódica el radio atómico aumenta de arriba hacia abajo ya que se aumenta el número de niveles de energía. En un período de la tabla periódica el radio atómico disminuye de izquierda a derecha ya que existe una mayor atracción entre electrones y protones y los átomos se hacen más pequeños.
Por ejemplo entre el Boro y el Galio es más grande el galio porque el Ga tiene más niveles de energía.
Entre el Mg y el Al es más grande el Mg porque tiene menos electrones.
La siguiente gráfica lo muestra claramente.

ENERGÍA DE IONIZACIÓN
La energía de ionización o potencial de ionización es la energía necesaria para separar un electrón de mayor energía de un átomo gaseoso en su estado basal o neutro (igual número de electrones y de protones): cuando un átomo tiene más energía, tiene la capacidad de atraer electrones de otros átomos hasta capturarlos, entonces se producen cargas eléctricas en los átomos convirtiéndolos en aniones o sustancias que aceptan electrones, y en cationes o sustancias que ceden los electrones.
Por ejemplo el elemento sodio (Na), tiene menor energía de ionización que el elemento cloro(Cl). El Francio tiene menor energía de ionización que el Potasio.
Es una propiedad periódica que aumenta y disminuye de igual forma como lo hace la electronegatividad.

TALLER No 2
Con base en la explicación, gráficos y en el video de propiedades periódicas responde:
1. Explica el concepto de electronegatividad.
2. Responde cuál elemento es más electronegativo en cada caso de las siguientes parejas de elementos:
a. Fr o K,
b. B o Ga,
c. F o Br.
d. Li o N
e. Ge o Fe
3. Explica el concepto de Radio atómico.
4. Responde cual elemento presenta mayor radio atómico en las siguientes parejas de elementos:
a. Li o C
b. Ca o Fe
c. C o Si.
d. P o Sb.
5. Explica el concepto de energía de ionización. Da un ejemplo de cuando se forma un ión.